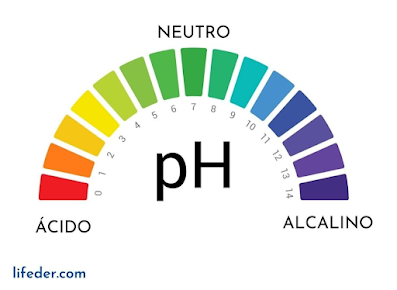
En química, el pH es una escala numérica utilizada para especificar la acidez o
alcalinidad de una solución acuosa. Es el logaritmo negativo en base 10 de la actividad
del ion Hidrógeno.
Las soluciones con un pH menor a 7 son ácidas, por el contrario las soluciones
con un pH mayor a 7 son alcalinas o básicas. El agua pura tiene un pH de 7, lo que se
refiere a que es neutral es decir, ni ácida ni alcalina1
. Contrariamente a la creencia
popular, el valor del pH puede ser menor que 0 o mayor que 14 para los ácidos y las
bases muy fuertes. Sin embargo, estos extremos son difíciles de medir con precisión (Lim
2006).
Las cuantificaciones del pH son muy importantes en diversas ramas del
conocimiento científico como la biología, la medicina, la química, la agricultura, la
silvicultura, la ciencia de los alimentos, las ciencias ambientales, la oceanografía, la
ingeniería química, la nutrición, el tratamiento y la depuración de aguas entre muchas
otras.
Fuente: http://www.cua.uam.mx/pdfs/conoce/libroselec/17pHTeoriayproblemas.pdf.
Seguramente has escuchado en comerciales que algunos productos como jabones, champús o cremas para el cuerpo tienen un valor de pH “balanceado” que no debe ser muy ácido ni muy básico. De la misma manera, las soluciones que recorren tu cuerpo tienen un valor de pH que debe mantenerse dentro de ciertos límites para que tu organismo funcione bien. Por esto es válido preguntarse, ¿qué explica y cómo se determina el valor de pH en las soluciones?
PRACTICA DE LABORATORIO:
Materiales
- ·
Vasos y cuchillos
- ·
Zanahoria
- ·
Agua
- ·
Sal
- ·
Zumo de limón
- ·
Vinagre
- ·
Alcohol
- ·
Detergente
- ·
Bicarbonato
PROCEDIMIENTOS
Cómo
hacer un indicador de pH casero
Dado el factor corrosivo y potencialmente
tóxico de algunos de los materiales que utilizaremos en este experimento es
importante que se tomen las medidas de precaución adecuadas. Entre ellas,
recomendamos realizar este ejercicio en presencia de un adulto.
1. Lamina la zanahoria con ayuda de un cuchillo.
2. Se muele la zanahoria con alcoho
3. Vierte la zanahoria en 6 vasos transparentes diferentes.
4. A continuación, vierte cada uno de los 6 materiales que
necesitas para hacer este medidor de pH casero. Cuando lo hagas, acuérdate de
remover bien con una cuchara diferente para diluir la mezcla.
5. Verás que las mezclas
han adoptado diferentes colores.
6. De acuerdo al color determina si cada sustancia es bàsico, neutro o àcido.
7. Realiza un informe con lo aprendido.

Comentarios
Publicar un comentario